الفيديوات بالعربية في الاسفل !!
لمتابعة الفيديوات اللاحقة، اضغط على السهم الاخضر أسفله
تتمة دراسة الأحماض و القواعد و سنكمل ما بدأناه حول مخطط الهيمنة و أشياء أخرى أكثر امتاعا 🙂 فرجة ممتعة.
التحولات في تفاعلات حمض-قاعدة – الدرس 1 –
الفيديو الأول :
الدقيقة 00:00 : تتمة التعرف عى مخطط ىالهيمنة التي يبين لنا ما هو العنصر المهيمن في المحلول و ذلك بعد عمل مقارنة بين pH و pKa .

الدقيقة 01:05 : مثال تطبيقي سهل عن طريق المزدوجة -HCOOH/HCOO حيث أن Pka=3.8 و نقيس pH المحلول فنجد أنه 5.5 ,
السؤال : ما هو العنصر المهيمن في هذه الحالة ؟ ,
باستخدام مخطط الهيمنة نستنتج أن القاعدة -HCOO هي المهيمنة في المحلول لأن : pH > pKa .
الدقيقة 03:53 : معايرة حمض/قاعدة .
الدقيقة 04:21 : ما هو تعريف المعايرة ؟ : المعايرة هو تفاعل تدريجي بين : – حمض حجمه معروف Va و لكن تركيزه مجهول Ca مجهول. و بين قاعدة تركيزها معروف Cb تكون في سحاحة نضيفها تدريجيا و نعلم الحجم المضاف Vb.
الدقيقة 06:56 : كيفية القيام بالمعايرة ؟ : أنظر الشكل التوضيحي الذي يبين الأدوات و البنية التجريبية المستعملة :
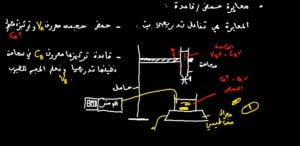
الأدوات التي سنستخدمها في هذا التركيب التجريبي :
- كأس يحتوي على المحلول الحمضي ذو التركيز المجهول و الذي يكون محراك مغناطيسي.
- سحاحة و الذي يعتبر أنبوبا طويلا يحتوي على المحلول القاعدي يتم صبه بالتدريج الى حين يتم الحصول على حالة التوازن نغلقه.
- حامل السحاحة.
- جهاز pH متر يحتوي على الكترود يتم وضعه في المحلول.
الدقيقة 13:11 : أثناء صب المحلول يتم انشاء جدول من أجل قياس Vb و pH.
الفيديو الثاني :
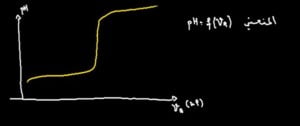
الدقيقة 00:00 : أثناء قياس كل من الحجم و pH نلاحظ أن pH في وقت محدد يتغير بسرعة كبيرة
فبعد اضافة قدر من المحلول , يقوم pH بالارتفاع ( أو الانخفاض ) بشكل متسارع . في هذه الحالة نقول أننا قد وصلنا الى نقطة التكافؤ
الدقيقة 01:03 : منحنى ph بدلالة Va .
الدقيقة 02:00 : ماذا يحدث عند نقطة التكافؤ أثناء المعايرة ؟ :
عند التكافؤ , تكون كمية مادة العنصر المعايَر تساوي كمية مادة العتصر المعايِر , و نكتب :
Ca.Va = Cb.Vbe
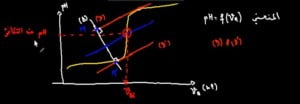
الدقيقة 03:58 : كيف يمكن ايجاد كمية المحلول في حالة المعايرة حمض-قاعدة ؟ : من اجل القيام بذلك نستعمل طريقة المماسات.
الدقيقة 04:27 : ما هي طريقة المماسات لايجاد نقطة التكافؤ في معايرة ؟
- نرسم مماس بعد نقطة التكافؤ.
- نرسم مماسا قبل نقطة التكافؤ بحث أن هذا المماس يكون موازيا للماس الأول.
- نرسم مستقيم عمودي على المستقيمين السابقين.
- نرسم واسط القطعة [m’m].
- نقطة التكافؤ هي تقاطع هذا الواسط و منحي pH.




j’ai une remarque f lmo3ayara wache dimaa l7imde kikoone tarkize dyalo majhoole ?