الفيديوات بالعربية في الاسفل !!
لمتابعة الفيديوات اللاحقة، اضغط على السهم الاخضر أسفله
رأينا في أول السنة تفاعلات الأكسدة/اختزال في درس التحولات السريعة البطيئة. في هذا الدرس سوف نحاول تطبيق هذه المعارف في هذا الدرس و الذي سيكون مخصصا من أجل معرفة ماذا يحدث داخل الأعمدة الكهربائية من تفاعلات بين مكوناته.
درس أكثر من رائع و ممتع في نفس الوقت … تابع معي :
الفيديو الأول :
الدقيقة 01:00: الأعمدة الكيميائية هو نوع خاص من تفاعلات أكسدة اختزال و هو من التفاعلات الغير مباشرة.
الدقيقة 01:45 : مثال سهل عن تفاعل أكسدة/اختزال بين المغنزيوم و حمض الكلوريدريك و هو عابرة عن تفاعل أكسدة اختزال بين مزدوجتين. Mg2+/Mg و H+/H2.
الدقيقة 04:22 : نصف معادلات أكسدة اختزال المتعلقة بتفاعلات المزدوجتين.
الدقيقة 06:07 : المعادلة الحصيلة الناتجة عن تفاعل المكونين في المحلول.
الدقيقة : تعريف الأكسدة اختزال : و الذي يعتبر تفاعل يتم فيه تبادل الالكترونات بين مزدوجتين.
الدقيقة 08:38 : مصير الالكترونات المحررة في الحلول , كما نعلم أن تفاعل الاكسدة هو تفاعل محايد كهربائيا و بالتالي عندما يقوم عنصر بتحرير الكترون , يذهب مباشرة الى الطبقة الخارجيبة للعنصر الثاني. و بالتالي يمككنا القول أن الالكترونات لا توجد في المحلول , بمجرد ما تنتج تتفاعل و بالتالي يمكن ان نستنتج أن الالكترونات لا تحب الماء.
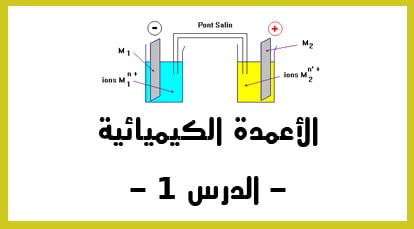
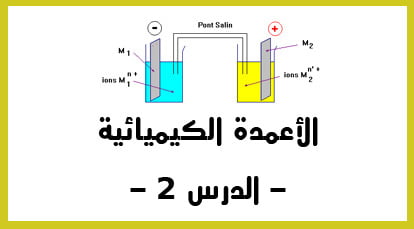
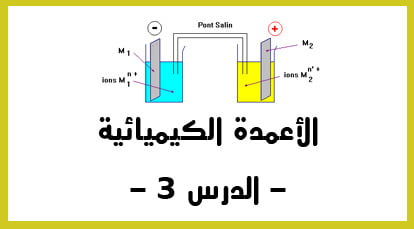
الدقيقة 11:48 : دراسة الأعمدة : مثال تطبيقي سهل و مشهور في دراسة الأعمدة الكهربائية يسمى ب “عمود دانيال“.: و الذي يعتبر محلولا فيه أيون النحاس مغمور فيه الكترود من نحاس و الذي يعتبر الكترود موجب و الذي يسموى الكاثود. – التكملة في الفيديو الثاني –
الفيديو الثاني :
الدقيقة 00:00 : نكمل الشرح المفصل ” لعمود دانيال – : في الاناء الثاني أو المحلول الثاني و الذي يحتوي على أيونات Zn2+ – أيونات الزنك – ثم نغمر فيه صحيفة من الزنك باشارة سالبة يسمى الأنود.
الدقيقة 01:36 : ما هي أهمية استعمال القنطرة الألكتروليتية ؟ أو القنطرة الملحية ؟ ( تصل بين المحلولين و التي تحتوي على أيون البوتاسيوم. ) من أجل ضمان الحياد الكهربائي
الدقيقة 03:13 : في المحلول الأول الذي يحتوي على المزدوجة Cu و Cu2+ سيحدث اختزال و ذلك وفق المعادلة التالية :
Cu2+ +2e- <=> Cu
الدقيقة 05:08 : في المحلول الثاني الذي يحتوي على المزدوجة Zn و Zn2+ يحدث تفاعل أكسدة و ذلك وفق المعادلة التالية:
-Zn <=> Zn2+ +2e
الدقيقة 06:30 : الأكسدة يتم فيها انتاج أو تحرير الالكترونات و مرحلة الاختزال يتم فيها استهلاك الالكترونات.
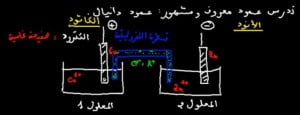
الدقيقة 08:15 : كيف يتم انتقال الالكترونات بين محلولين في حالة الأعمدة الكهربائية ؟
الدقيقة 10:00 : ماذا يجب ان نفعل من أجل أن تتم عملية الأكسدة و الاختزال في الصفيحتين ؟ : في هذه الحالة لا بد من تواجد مستقبل كهربائي , سواءا بمقاومة كهربائية أو مصباح –
الدقيقة 11:37 : ماذا يحدث أثناء ربط الكاثودين بمقاومة R أو مستقبل كهربائي ؟ :
=> تبدأ تفاعلات الأكسدة في المحلول 2 و الاختزال في المحلول 1.
الدقيقة 12:50 : رسم مبياني سهل وواضح يمثل ماهي التفاعلات التي تحدث في حالة ربط الكترودين العمود الكيميائي بمقاومة R .