في هذا الدرس المهم سوف نرى قانون صودي لانحفاظ عدد الشحنة و انحفاظ عدد النويات. لكن قبل ذلك نحتاج لمراجعة سريعة لبنية الذرة و مكونات نويدة من بروتونات و نوترونات. هذه هي الاساس لفهم درس التناقص الإشعاعي السهل و تحقيق نقط مشرفة فيه في الامتحان.
الفيديوات بالعربية في الاسفل !!
لمتابعة الفيديوات اللاحقة، اضغط على السهم الاخضر أسفله
مكونات الذرة ومكونات نويدة في التناقص الاشعاعي
الذرات او النويدات في هذا الكون لا تكون مستقرة دائما. بل هناك ذرات نسميها ذرات مشعة. و هي التي ندرس بعمق في درس التناقص الاشعاعي. هذه الذرات الخاصة يمكنها أن تفقد أو تكتسب الالكترونات أو البروتونات أو النيوترونات في حالات معينة.
سنبدأ بالتذكير بالاساسيات التي سنستخدمها في هذا الدرس (التناقص الاشعاعي) و بالخصوص بتذكير مفصل حول مكونات الذرة.
لنبدأ!
الفيديو الأول :
الدقيقة 00:00 : التذكير بمكونات الذرة : الذرة تتكون من نواة تحيط بها الكترونات .
هذه النواة التي تقع في المركز، تتكون من نوعين من النويات داخلها : البروتونات P و النيوترونات N.
الاختلاف بينهما هو أن شحنة البروتونات هي شحنة موجبة و شحنة النوترونات هي شحنة محايدة تساوي صفر.
أما بالنسبة للالكترونات فهي تحتوي على شحنة سالبة. و هي تدور على شكل سحابة الكترونية nuage d’electrons حول النواة.
الدقيقة 01:54 : مبدأ الحياد الكهربائي للذرات :
بصفة عامة يجب أن تكون كل ذرة محايدة كهربائية . مثال : ذرة الحديد , ذرة الزنك . و هذا هو السبب أننا لا نصعق عندما نمسك طاولة حديدية مثلا، أو لا “يضربنا الضوء” عندما نفتح باب السيارة المصنوع من الزنك أو الحديد.
في المستوي الذري، هذا الحياد الكهربائي يعني أن شحنة الالكترونات السالبة تساوي شحنة البروتونات الموجبة، و بصيغة أخرى، يعني أن عدد الالكترونات يساوي عدد البروتونات. الشيئ الذي نرمز اليه بالعلاقة Z = P
P : عدد البروتونات
Z : عدد الالكترونات
من جهة أخرى، نضع أيضا N : عدد النوترونات
Z : عدد الالكترونات
الدقيقة 03:58 : نمثل الذرة برمز X يعطينا اسمها مع عددين A و Z.
حيث A هو عدد الكتلة و Z يسمى عدد الشحنة.
بحيث عدد الكتلة A يساوي عدد البروتونات زائد عدد النوترونات في النوية.
و عدد الشحنة يساوي عدد البروتونات في النوية، أو عدد اللالكترونات فيها.
الدقيقة 05:11 : علاقة عامة في درس التناقص الاشعاعي، يجب معرفتها و حفظها :
نعلم أن A = P + N و P=Z
الدقيقة 05:39 : مثال سهل حول مكونات الذرة باستخدام ذرة الرصاص .
حيث أن A = 206 و Z = 82 :
البروتونات : 82
الالكترونات : 82
و منه نستنتج أن عدد النوترونات : A -Z = 206 -82=124
الدقيقة 08:04 : النوى المشعة هي نوى غير مستقرة. بمعنى أننا إذا تركناها لوحدها لمدة معينة، فهذه النوى لن تبقى على حالتها الاصلية.
بل النوى المشعة سوف تتفتت تلقائيا لتعطينا نوى أخرى أكثر استقرارا.
الدقيقة 09:37 : سؤال يطرح كثيرا: هل جميع الذرات مشعة ؟
الجواب هو :لا ليست جميع الذرات مشعة.
الدقيقة 10:09 : مثال توضيحي سهل حول اشعاعية الذرات. لنتعرف على نظائر الصوديوم حيث أن فيها الصوديوم المستقر و الصوديوم المشع.
ما هو تعريف النظير في درس التناقص الاشعاعي؟
هو نوية تحتوي على نفس عدد الشحنة Z لكنها تتوفر على عدد كتلة A مختلف.
قوانين التناقص الاشعاعي – قانون صودي
الدقيقة 11:18 : خصائص التفتت الاشعاعي :
- تلقائي.
- عشوائي.
الدقيقة 11:40 : قوانين التناقص الاشعاعي : هذه التفتتات الاشعاعية رغم أنها عشوائية و تلقائية الا انها تحترم عدة قوانين
الدقيقة 12:30 : قوانين صودي Soddy :
- انحفاظ الشحنة Z : أي أن عدد الشنة للذرة الأم هو نفسه مجموع عدد الشحنة للعناصر الناتجة عن هذا التفتت الاشعاعي.
- انحفاظ عدد الكتلة أو عدد النويات A : بمعنى أن عدد النويات (البروتونات و النوترونات) للعنصر المشع الاصلي هي نفسها عدد النويات للعناصر الناتجة عن هذا التناقص الاشعاعي.
الدقيقة 14:02 : مثال توضيحي سهل عن قانون صودي باستخدام البولونيوم . حيث أن هذا التفتت ينتج عنه ذرة الرصاص و ذرة الهيلوم.
الفيديو الثاني :
الدقيقة 00:00 : تتمة المثال التوضيحي السهل للتفتت الاشعاعي لذرة البولونيوم.
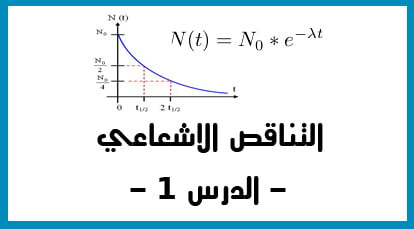
الدقيقة 02:20 : قوانين التناقص الاشعاعي N(T).
أنواع النشاط الاشعاعي – كيف نفهم التناقص الاشعاعي
الدقيقة 03:19: لنر الان أنواع النشاط الاشعاعي أو أنواع التفتتات الاشعاعية :
النشاط ألفا : الدقيقة ألفا هي ذرة الهليوم.
ماذا يقع في هذا النشاط الاشعاعي؟ في هذا التفتت نحصل على ذرة ألفا في التفتت الاشعاعي. أي أن ذرة الهليوم تكون من بين النواتج.
النشاط بيطا ناقص -B : الدقيقة B- هي الكترون. و في هذا النشاط الاشعاعي نجد في النواتج الكترون بالاضافة الى نوية أخرى.
لنر سويا مثال توضيحي سهل باستخدام عنصر الفضة المشعة الذي يعطي عنصر الكادميوم و الكترون.
النشاط بيطا زائد +B : هذا العنصر يسمى البوزترون و هو عكس شحنة الالكتروني , مثال توضيحي لهذا التفاعل باستخدام ذرة الكوبالت و التي تعطي ذرة الحديد زائد بوزترون.
هل تجد مشاكل في تحضير الباك الحر؟ هل تحتاج الى طريقة لتنظيم وقتك و عمل برنامج مراجعة جيد للفيزياء و التناقص الاشعاعي ؟
ادخل اسمك و ايميلك هنا و التحق بأكثر من 52431 مترشح يستفيدون الان






ya que ces 2 video ? ?
Chouff fel menu rapide 3LA liymen Ahmed ….
http://www.***********/index.php/tour-gratuit/tour-gratuit-physiques/decroissance-nucleaire-cours-1/decroissance-nucleaire-cours-2/
salam oustad wach kaynin ghéér 4 7éét fla page kayn 3adad les vidéo 8 ???
ana 3andi mochkil f svt..