الفيديوات بالعربية في الاسفل !!
هذا الجزء خاص بمراجعة درس الاحماض و القواعد.
ملاحظة : في الثانية باكالوريا و في الامتحان الوطني لذيك احتمال %90 لكي تتعامل مع هذا النوع من التفاعلات.
الفيديو الأول :
الدقيقة 00:00 : ما هو الحمض حسب برونشتد ؟ : الحمض حسب برونشتد هو كل عنصر يمكن أن يحرر/ يعطي أيون +H و ذلك وفق المعادلة الثالية :
+AH <=> A- + H
الدقيقة 01:12 : ما هي القاعدة حسب برونشتد ؟ : القاعدة حسب برونشتد هي كل عنصر قادر على أن يكتسب أيون +H و ذلك وفق المعادلة الثالية :
+B + H+ <=> BH
حيث أن الاحماض و القواعد تكون في غالب الأحيان عبارة عن مزدوجات قاعدة/حمض :
الدقيقة 03:27 : كيف يمكن الحصول على معادلة كاملة بين حمض و قاعدة ؟ : يتم ذلك عن طريق تفاعل حمض المزدوجة الأولى مع قاعدة المزدوجة الثانية و ذلك وفق القاعدة Gamma.
الدقيقة 04:46 : مثال تطبيقي أول حول تفاعل حمض و قاعدة .
الدقيقة 05:39 : كيفية تحديد أنصاف المعادلات لكل مزدوحة من اجل تحديد المعادلة الكلية للتفاعل الكيميائي ؟
الدقيقة 08:43 : المثال الثاني الخاص بتفاعل الحمض و القاعدة عن طريق تفاعل مزدوجة الماء و مزدوجة حمض الأمونياك.
الدقيقة 11:10 : تعريف pH محلول مائي و الذي يمكن حسابه بالعلاقة التالية :
([+pH = -log([H3O
و هو مقدار بدون وحدة.
الدقيقة 13:52 : كيف يمكن تحديد تركيز أيونات الأمونيوم باستخدام قيمة pH ؟ : يمكن ذلك عن طريق استخدام العلاقة التالية :
H3O+] = 10^-pH]
الفيديو الثاني :
الدقيقة 00:00 : تذكير ببعض علاقات الدوال اللوغارتمية التي سيتم استخدامها في هذ الدرس.
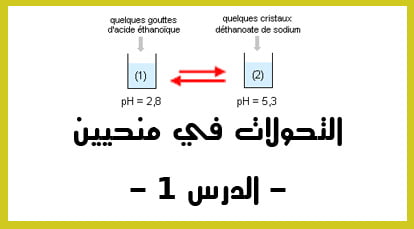
الدقيقة 00:56 : كيف يتم قياس pH في محلول مائي ؟ : يتم ذلك عن طريق استخدام pH متر بحيث :
- اذا كانت ph > 7 فان المحلول حمضي.
- اذا كانت pH < 7 فان المحلول حمضي.
- اذا كانت pH = 0 فان المحلول قاعدي.
الدقيقة 03:00 : التعريف ببعض خاصيات التفاعلات الكيميائية حيث أنه في تفاعل كيميائي لا يكون التحول كليا أي أنه يوجد المحلول في نفس الوقت المتفاعلات و النواتج.
الدقيقة 05:42 : ما هو الفرق بين الحالة النهائية و الحالة القصوية في تفاعل كيميائي ؟
الدقيقة 06:35 : كيف نحسب نسبة تقدم التفاعل To ؟ هي عبارة عن قيمة بدون وحدة يتم ايجادها بالعلاقة التالية :
To = xf / xmax
و يمكن أن نحصل على أحد القيم :
- To = 1 و في هذه الحالة فان التفاعل كلي.
- To < 1 يعني أن التفاعل غير كلي و تسمى هذه الحالة بالتوازن الكيميائي.



Ostad lah ijazik bikhir 🙂 gouliya 3lach derti Hcl = H+ +CL – ou machi HCL + H2O f dawaban fel mae achnou l far9 ? Merci .
Ne9edrou ndirou jouj dyal kitabates :
HCl —> H+ + Cl-
Awella : HCl + H2O —> H+ + Cl- + H2O
AL mou3adala khasseha tekoune moutawazina : ghed hydrogène 3ala lysser ged li 3ala lyman, ghed Oxygène 3ala lysser ged li 3ala lyman,
ghed Chlore 3ala lysser ged li 3ala lyman,
Des Réponse ?????
Salam Oustad Jamal 🙂 😀 !
Video 1 – Da9i9a : 6:10
– 3lach maktabnach H3O + = H+ + H2O – , fou9tach ka ndirou dak na9iss fnihayat l moutafa3il et merci beaucoup 🙂 .
(ostad ach kan9sdo bi nisbat ata9adom atafa3ol (to
to = xf/xmax
kate3tina fikra 3la fin wesel atafa3oul
30% , 60% wella 100%
????? ???? ?????? ??? ????? ??? ?????? ??????? ??????? ?????????? ?? ???? ???? ??? ?? ?????? ?? ??? ??? ??? ????? ??????? ???? ???? ?????? ???? ????? ????? ??? ?? ?? ?? ?????? ????? 84 ????? ???? ??? ??? ??????? ?????? ??? ?????? ??? ?????? ????? ?? ?????? ???? ???????? ?? ?? ???? ??? ???????? ???? ??????? ?????????? ??????? ?? ??????????????? ??????? ??????? ???? ????? 2012 2011 2010 2009 2008 2007
??????? ???? ?????? ??? ?? ??? ?????? ?????????? ??? ???? ???????? ???? ???? ???? ???? ???? ?? ?????????? ????????? ????????? ???????? ??? ???? ?????
Marhba bik Fouad me3ana fe baclibre.ma.
Hounaka wataniyate mousahaha mais elles sont cachées. Travaille seulement les exercices un à un et ne t’inquiète pas pour le BAC.
Ici tu travaillera la base, et tu comprendra vraiment les méthodes de rédaction, et les erreurs à éviter.
Oustad bnisba l dik
Xeq + ???? Qr,eq + ???? pKa1 ???? ??? ?? ?????? ?????? ??? ??? ???????? ?? ??? ?? ???? svt
Chouf hna : http://www.***********/index.php/2010/11/etat-d-equilibre-d-un-systeme-chimique-cours/
et
http://www.***********/index.php/category/chimie-cours/reac-acidobasiques/
oustad 3afak fin dakchchi dyal lmouwasalla wl mousilya ?