التحولات التلقائية للتفاعلات الكيميائية تبين الحالة العادية التي تتصرف فيها المتفاعلات، اي بدون تدخل مباشر للكميائي.
الفيديو الأول :
الدقيقة 00:00 : ما هو خارج التفاعل الكيميائي Q ؟
في معادلة كيميائية و التي تكتب على الشكل التالي :

نعرف خارج التفاعل في كل لحظة t بالعلاقة التالية :
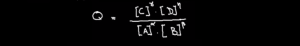
بحيث عوامل هذه العلاقة عبارة عن تراكيز المتفاعلات و تراكيز النواتج.
الدقيقة 02:44 : الحالات الخاصة لحساب خارج التفاعل :
- في حالة وجود الماء في المتفاعلات و النواتج.
- في حالة جسم صلب
حيث أن في هذه الحالة نأخد تراكيز هذه العناصر تساوي 1، اصطلاحا.
الدقيقة 04:11 : المثال الأول السهل الذي يوضح كيفية حساب خارج التفاعل لمعادلة تفاعل لأيون الحديد الثالث و أيون الفضة.
الدقيقة 06:24 : المثال الثاني لحساب خارج التفاعل بتواجد الغاز و الماء.
معادلة التفاعل : Zn + 2H3O+ <=> Zn2+ + H2 +H2O
الفيديو الثاني :
الدقيقة 00:00 : ما هي ثابتة التوازن ؟
عتدما يصل التفاعل الى التوازن يعني يتوقف التفاعل يعني يصل التفاعل الى الحالة النهائية , يمكن حساب ثابتة التوازن K .و التي تحسب بعلاقة خارج التفاعل و لكن في حالة التوازن و نكتب :
K = Qr,éq
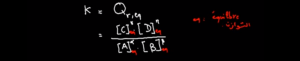
الدقيقة 02:56 : المثال الاول السهل حول كيفية حساب ثابتة التوازن ،K في حالة تفاعل حمض الميثانويك و الماء.
معادلة التفاعل : +HCOOH + H2O <=> HCOO- + H3O




finahowa al vedio a ostad makiban waalo ???
Chouf daba Tawfik.