الفيديوات بالعربية في الاسفل !!
لمتابعة الفيديوات اللاحقة، اضغط على السهم الاخضر أسفله
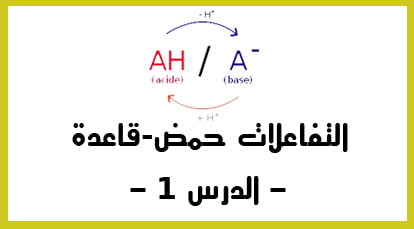
التفاعلات حمض قاعدة … أينما ذهبت ستجدها … و التي تستدعي تواجد عنصر قادر على طرح/ انتاج بروتون و عنصر كيميائي قادر على استقباله.
الفيديو الأول
الدقيقة 00:00 : التعرف على ثابتة التوازن المقرونة بالتحليل الذاتي للماء Ke . و التي تكون بدون وحدة و علاقاتها هي :
[+Ke = [HO-]*[H3O
و تسمى أيضا التحلل الذاتي للماء.
الدقيقة 4:01 : التعرف على علاقة حساب ph (حمضية المحلول) انطلاقا من تركيز أيونات الأوكسونيوم.
([+ph = – log ([H3O
و تطبيق هذه العلاقة على مثال تطبيقي. و يمكننا استعمال علاقة درس الدوال اللوغارتيمة من أجل الحصول على تعبير ph بدلالة pke و تركيز HO-
[[-ph = pke + log ([HO
الدقيقة 7:25 : ملاحظة رياضية و التي تتمثل في أن :
(pke = – log (Ke
الدقيقة 8:30 : علاقة عامة أساسية يجب ان لا تنساها ابدا : كل مزدوجة حمض قاعدة تتفاعل مع الماء حسب العلاقة :
+A + H2O <=> B + H3O
الدقيقة 10:10 : التعرف على ثابتة التوازن لهذا التفاعل K ,التي نسميها أيضا ثابتة الحمضية Ka للمزدوجة A/B.
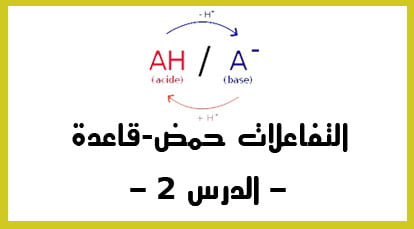
الفيديو الثاني :
الدقيقة 00:00 : العلاقة بين pH , pKa ; و تركيز العنصرين A و B
الدقيقة 05:06 : ثابتة التوازن عند التوازن. و كيف نحسبها ببساطة.
الدقيقة 11:28 : التعرف على مخطط الهيمنةللمزدوجة A/B.
و الذي يكمن من معرفة ما هو العنصر المهيمن في المحلول هل هو الحمض أو القاعدة .



ou pouvons nous trouver le cours d ” lmou3ayara” ??, merci d’avance
Tel9ahoum hna : http://www.***********/index.php/chimie/transformations-avec-reactions-acido-basiques-exercices-1/
Salam Oustad Jamal 🙂 😀
Ou peut on trouvé ” Hisab tarkiz intila9an men l jadwal l wasfi ? ” et merci beaucoup beaucoup 🙂 😀 .
Monsieur, SVP Je veux le site que vous l’avait en français
vous avez un site parallèle comme celui là mais en français